Unsur kimia, atau hanya disebut unsur, adalah zat kimia yang tak dapat dibagi lagi menjadi zat yang lebih kecil, atau tak dapat diubah menjadi zat kimia lain dengan menggunakan metode kimia biasa. Partikel terkecil dari unsur adalah atom. Sebuah atom terdiri atas inti atom (nukleus) dan dikelilingi oleh elektron. Inti atom terdiri atas sejumlah proton dan neutron. Hingga saat ini diketahui terdapat kurang lebih 117 unsur di dunia.
Gambaran umum
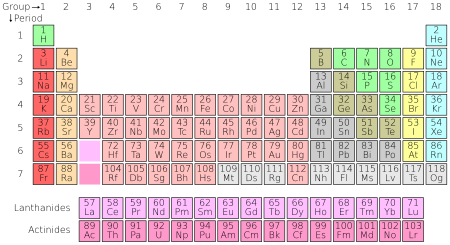
Hal yang membedakan unsur satu dengan lainnya adalah "jumlah proton" dan jumah elektron suatu unsur atau ikatan dalam inti atom tersebut. Misalnya, seluruh atom karbon memiliki proton sebanyak 6 buah, sedangkan atom oksigen memiliki proton sebanyak 8 buah. Jumlah proton pada sebuah atom dikenal dengan istilah nomor atom (dilambangkan dengan Z).
Namun demikian, atom-atom pada unsur yang sama tersebut dapat memiliki jumlah netron yang berbeda; hal ini dikenal dengan sebutan isotop. Massa atom sebuah unsur (dilambangkan dengan "A") adalah massa rata-rata atom suatu unsur pada alam. Karena massa elektron sangatlah kecil, dan massa neutron hampir sama dengan massa proton, maka massa atom biasanya dinyatakan dengan jumlah proton dan neutron pada inti atom, pada isotop yang memiliki kelimpahan terbanyak di alam. Ukuran massa atom adalah satuan massa atom (smu). Beberapa isotop bersifat radioaktif, dan mengalami penguraian (peluruhan) terhadap radiasi partikel alfa atau beta.
Unsur paling ringan adalah hidrogen dan helium. Hidrogen dipercaya sebagai unsur yang ada pertama kali di jagad raya setelah terjadinya Big Bang. Seluruh unsur-unsur berat secara alami terbentuk (baik secara alami ataupun buatan) melalui berbagai metode nukleosintesis. Hingga tahun 2005, dikenal 118 unsur yang diketahui, 93 unsur diantaranya terdapat di alam, dan 23 unsur merupakan unsur buatan. Unsur buatan pertama kali diduga adalah teknetium pada tahun 1937. Seluruh unsur buatan merupakan radioaktif dengan waktu paruh yang pendek, sehingga atom-atom tersebut yang terbentuk secara alami sepertinya telah terurai.
Daftar unsur dapat dinyatakan berdasarkan nama, simbol, atau nomor atom. Dalam tabel periodik, disajikan pula pengelompokan unsur-unsur yang memiliki sifat-sifat kimia yang sama.
[sunting]Tata nama
Penamaan unsur telah jauh sebelum adanya teori atom suatu zat, meski pada waktu itu belum diketahui mana yang merupakan unsur, dan mana yang merupakan senyawa. Ketika teori atom berkembang, nama-nama unsur yang telah digunakan pada masa lampau tetap dipakai. Misalnya, unsur "cuprum" dalam Bahasa Inggris dikenal dengan copper, dan dalam Bahasa Indonesia dikenal dengan istilah tembaga. Contoh lain, dalam Bahasa Jerman "Wasserstoff" berarti "hidrogen", dan "Sauerstoff" berarti "oksigen".
Nama resmi dari unsur kimia ditentukan oleh organisasi IUPAC. Menurut IUPAC, nama unsur tidak diawali dengan huruf kapital, kecuali berada di awal kalimat. Dalam paruh akhir abad ke-20, banyak laboratorium mampu menciptakan unsur baru yang memiliki tingkat peluruhan cukup tinggi untuk dijual atau disimpan. Nama-nama unsur baru ini ditetapkan pula oleh IUPAC, dan umumnya mengadopsi nama yang dipilih oleh penemu unsur tersebut. Hal ini dapat menimbulkan kontroversi grup riset mana yang asli menemukan unsur tersebut, dan penundaan penamaan unsur dalam waktu yang lama (lihat kontroversi penamaan unsur).
[sunting]Lambang kimia
Sebelum kimia menjadi bidang ilmu, ahli alkemi telah menentukan simbol-simbol baik untuk logam maupun senyawa umum lainnya. Mereka menggunakan singkatan dalam diagram atau prosedur; dan tanpa konsep mengenai suatu atom bergabung untuk membentuk molekul. Dengan perkembangan teori zat, John Dalton memperkenalkan simbol-simbol yang lebih sederhana, didasarkan oleh lingkaran, yang digunakan untuk menggambarkan molekul.
Sistem yang saat ini digunakan diperkenalkan oleh Berzelius. Dalam sistem tipografi tersebut, simbol kimia yang digunakan adalah singkatan dari nama Latin (karena waktu itu Bahasa Latin merupakan bahasa sains); misalnya Fe adalah simbol untuk unsur ferrum (besi), Cu adalah simbol untuk unsur Cuprum (tembaga), Hg adalah simbol untuk unsur hydrargyrum (raksa), dan sebagainya.
Simbol kimia digunakan secara internasional, meski nama-nama unsur diterjemahkan antarbahasa. Huruf pertama simbol kimia ditulis dalam huruf kapital, sedangkan huruf selanjutnya (jika ada) ditulis dalam huruf kecil.
[sunting]Simbol non-unsur
Non unsur, khususnya dalam kimia organik dan organometalik, seringkali menggunakan simbol yang terinspirasi oleh simbol-simbol unsur kimia. Berikut adalah contohnya:
Cy - sikloheksil; Ph - fenil; Bz - benzoil; Bn - benzil; Cp - Siklopentadiena; Pr - propil; Me - metil; Et - etil; Tf - triflat; Ts - tosil; Hb - hemoglobin.
[sunting]Kelimpahan
| Unsur | Ppm (w/w) |
|---|---|
| Hidrogen | 739,000 |
| Helium | 240,000 |
| Oksigen | 10,400 |
| Karbon | 4,600 |
| Neon | 1,340 |
| Besi | 1,090 |
| Nitrogen | 960 |
| Silikon | 650 |
| Magnesium | 580 |
| Sulfur | 440 |
| Kalium | 210 |
| Nikel | 100 |
wikipedia.org

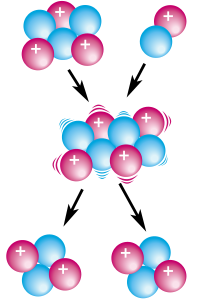

 ,
,









